Résumé scientifique
Il existe des preuves irréfutables que le système de système circadien joue un rôle fondamental dans la physiologie et la santé, et que la lumière, en plus d'être le principal synchronisateur de la symphonie circadienne, est un stimulus impérieux des fonctions non visuelles pendant la journée, et un stimulus nuisible avant ou pendant la nuit, bien que ses effets sur les structures impliquées dans le sommeil, l'éveil, la mémoire, l'humeur, la cognition, mais aussi la température, le métabolisme, le système cardiovasculaire, et peut-être bien d'autres encore qui restent à découvrir.
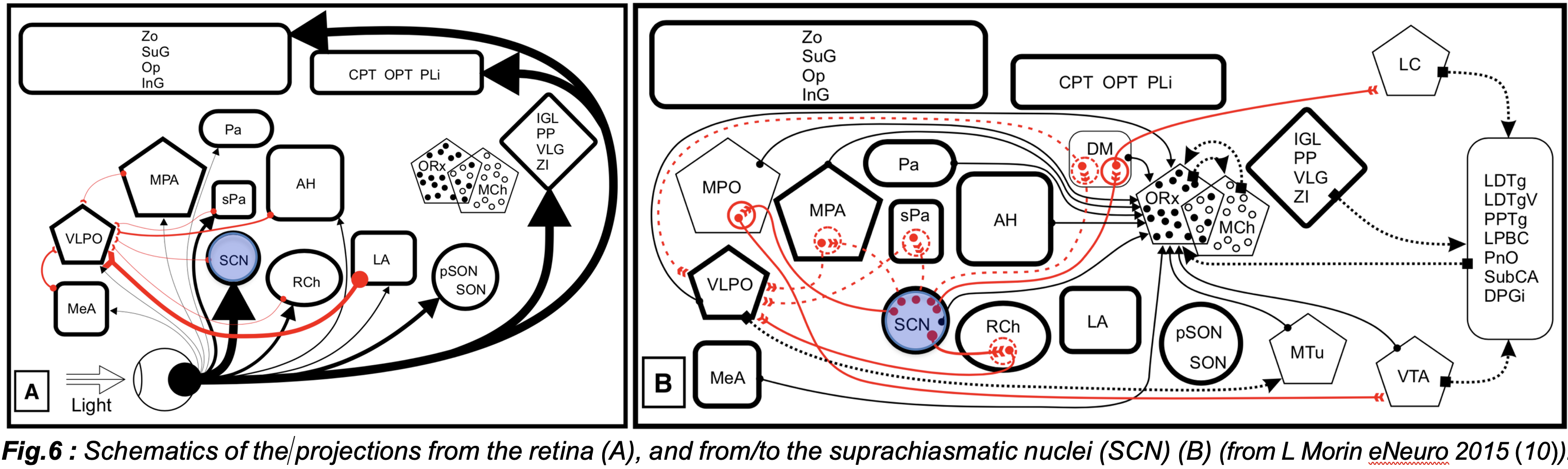
En effet, de nombreuses activités physiologiques telles que le cycle veille-sommeil, l'horaire et la structure du sommeil, la vigilance et la somnolence, les sécrétions hormonales, les performances cognitives, la fonction cardiovasculaire et la régulation du cycle cellulaire, sont sous le contrôle de l'horloge circadienne (circa : "proche de", dian : "un jour"), qui chez les mammifères est située dans le noyau supra-chiasmatique (NCS) de l'hypothalamus. Deux propriétés majeures caractérisent l'horloge circadienne : (1) la rythmicité est endogène, pilotée par des boucles moléculaires (gènes de l'horloge) à l'intérieur des cellules du NCS qui, à leur tour, génèrent des oscillations auto-entretenues de mise à feu neuronale, qui sont proches de 24 heures mais pas exactement de 24 heures ; (2) la rythmicité endogène est maintenue en synchronisation avec le jour de 24 heures par des entrées photiques du cycle lumière/obscurité de 24 heures, par une remise à zéro quotidienne (avance ou retard) de l'horloge (Prayag et al Clocks Sleep 2019). La lésion du SCN supprime l'expression des rythmes circadiens (aucune rythmicité n'est observée), alors que la suppression de l'entrée photique ne supprime que l'entraînement léger de l'horloge (le libre fonctionnement des rythmes proches de 24 heures est observé). Chez l'homme, l'importance de la synchronisation de l'horloge biologique est particulièrement perceptible dans le décalage horaire (après un voyage transméridien) et dans le travail posté, où l'on décrit couramment des baisses importantes des fonctions physiologiques (hormones, pression artérielle, température, système cardiovasculaire, métabolisme, division cellulaire, etc.), des performances neurocomportementales (mémoire, processus cognitifs), de la vigilance diurne et du sommeil. Nous avons conclu avec l'Agence française de santé (ANSES 2016) que le travail posté n'est pas seulement un facteur de risque de cancer (comme le propose l'Organisation mondiale de la santé), mais aussi de sommeil, de cognition, d'humeur, de troubles métaboliques et cardiovasculaires. On pense actuellement que la perturbation circadienne induite par le travail de nuit est impliquée dans le développement des symptômes et des maladies, mais les mécanismes précis impliqués sont inconnus.
L'information photique (lumière), nécessaire pour entraîner l'horloge à la journée de 24 heures, est transmise de l'œil au RCS par une voie monosynaptique : le tractus rétino-hypothalamique, qui est distinct des voies optiques impliquées dans la vision. La réponse du système circadien dépend de l'intensité, du moment, de la durée et des caractéristiques spectrales (longueurs d'onde) de la lumière. En plus des photorécepteurs classiques (bâtonnets et cônes), un sous-ensemble de cellules ganglionnaires rétiniennes intrinsèquement sensibles à la lumière exprimant le photopigment mélanopsine (ipRGC) est impliqué dans la photoréception circadienne. Ces cellules projettent vers le RCS, mais aussi vers des structures impliquées dans des fonctions non formatrices d'images (c'est-à-dire non visuelles) telles que le réflexe pupillaire de la lumière (OPN), la vigilance et le sommeil (VLPO), la cognition et la mémoire (hippocampe) et l'humeur (amygdale, VTA). La sensibilité maximale du photopigment mélanopsine se situe à ~ 480 nm (bleu-vert) chez toutes les espèces étudiées jusqu'à présent, y compris l'homme. Bien que l'on ait d'abord pensé qu'il fallait des intensités élevées et une longue exposition à la lumière, les ipRGC et les réponses non visuelles se sont récemment révélées très sensibles. En fait, nos récentes découvertes (Prayag et al J Pineal Res 2019) montrent que les réponses physiologiques à la lumière peuvent être initiées à des niveaux de lumière mélanopique extrêmement faibles, compatibles avec ceux mesurés dans les zones urbaines la nuit, ou avec les écrans LED (smartphones, tablettes, ordinateurs, téléviseurs). Nos résultats révèlent également que la lumière affecte le cerveau (EEG), le cœur et la température du corps dans les quelques minutes qui suivent l'exposition à la lumière (Prayag et al Frontiers Neurosci 2019). Dans l'ensemble, les résultats des études en laboratoire font craindre les conséquences d'une exposition inappropriée à la lumière (Hatori NPG Aging 2017). Sur la base d'un examen systématique des preuves disponibles, notre conclusion selon laquelle l'exposition à des niveaux même très faibles de lumière enrichie en bleu le soir ou la nuit a des effets perturbateurs sur les rythmes biologiques et le sommeil (Anses LED 2019), suggère que les conséquences fonctionnelles d'une exposition inappropriée à la lumière devraient être considérées comme un problème de santé publique. La encore, les mécanismes impliqués et leurs liens avec la physiologie non-visuelle et circadienne n'ont pas été systématiquement étudiés.
Notre recherche vise à évaluer le concept selon lequel l'exposition à la lumière (son moment, son intensité et son spectre) est cruciale pour optimiser l'éveil, le sommeil, la physiologie et la santé circadiennes ; à déchiffrer les mécanismes neurobiologiques impliqués ; et à évaluer la valeur physiologique et thérapeutique de la lumière pour éviter, soulager ou traiter des symptômes et des états pathologiques spécifiques.
For more information, please check out:
Our opinions, recently harvested by Inserm (French NIH):
The group of bright brains I have the privilege to work with:
Abhishek Prayag, PhD, Postdoc, non-visual effects of light, mathematical modeling
Ni Tang, MD, PhD student, neurologist, brain specialist, photobiology, chronobiology
Yanlong Hou, PhD student, molecular biologist/physiologist, photobiology, chronobiology
Xi Wang, PhD student, olfaction/food intake specialist, sleep/circadian processes in food intake
Toky Rakotoarivelo, PhD student, engineer, multimodal integration of sensory inputs, modeling
Sabine Plancoulaine, MD PhD, CR Inserm, epidemiologist and sleep specialist
Patricia Franco, MD PhD, PU-PH, sleep specialist
Véronique Raverot, Biologist, PH, expert in hormonal assays (HCL)
Lydie Merle, Technician, Clinical Research Associate (CRA/ARC)
MORE on our human group on sleep and circadian rhythms : https://www.crnl.fr/fr/page-base/groupe-sommeil-rythmicite-circadienne-lhumain-epidemiologie-populationnelle-recherche












